Nachhaltiger Biosimilars-Markt in Europa - Die Auswirkungen der Biosimilar-Lücke
Neue Studie veröffentlicht – Für 55 % aller Biologika, deren Patente zwischen 2023 und 2027 auslaufen, befinden sich derzeit keine Biosimilars in Entwicklung. Ein Wettbewerb durch Biosimilars ist daher nicht gewährleistet.
Das IQVIA Institute for Human Data Science hat im Oktober 2023 eine Studie mit dem Titel „Assessing the Biosimilar Void – Achieving Sustainable Levels of Biosimilar Competition in Europe” veröffentlicht. Diese Studie zielt darauf ab, Akteure im Gesundheitswesen bei der fundierten Entscheidungsfindung zu unterstützen, um sich effektiv auf zukünftige Herausforderungen vorzubereiten. In der Untersuchung wurden die bevorstehenden Patentabläufe (sogenannte Loss of Exclusivity-Events, LoEs) sowie die aktuellen Produktentwicklungsaktivitäten in Europa analysiert. Dabei lag der Fokus darauf, die Situation des nachhaltigen Wettbewerbs am europäischen Biosimilarsmarkt zu beurteilen. Besondere Aufmerksamkeit galt der Frage, ob eine potenzielle Lücke bei Biosimilars (ein sogenannter ‚Biosimilar Void‘) besteht.
Als Biosimilarsverband Österreich haben wir diesen Bericht mit Interesse aufgenommen und möchten Sie auf seine Veröffentlichung hinweisen. Wir haben im Folgenden aus unserer Sicht besonders wichtige Aussagen daraus zusammengefasst. Den vollständigen Bericht finden Sie am Ende dieses Dokuments über den bereitgestellten Link.
ANALYSE DES BIOSIMILAR-WETTBEWERBSPOTENTIALS IN EUROPA BIS 2032
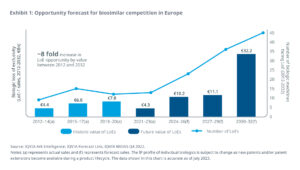
- Kosteneinsparungen in Europa durch den Einsatz von Biosimilars beliefen sich bis Ende 2022 auf mehr als 30 Mrd. Euro (kumulativ, zu Listenpreisen)
- Dies entspricht ca. 10% der jährlichen Arzneimittelausgaben in Europa
- Bis Ende 2032 werden in Europa voraussichtlich 110 Biologika ihren Patentschutz verlieren
- Das LoE-Potential übersteigt von 2024-2032 den Betrag von 50 Mrd. Euro
ANALYSE DER BIOSIMILAR ENTWICKLUNGS-PIPELINE FÜR DEN EUROPÄISCHEN MARKT:
Die 110 biologischen Arzneimittel, die bis Ende 2032 ihren Patentschutz verlieren, lassen sich in 2 Klassen einteilen:
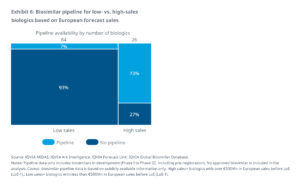
1.) Die „high sales“-Kategorie von Produkten mit einem Jahresumsatz über 500 Mio. Euro – 26 Biologika fallen in diese Kategorie
- 27% aus dieser Kategorie haben noch keinen Biosimilar-Kandidaten in der Entwicklungs-Pipeline.
- Dies entspricht einem potentiellen Einsparungsvolumen von 8 Milliarden, dass für die Kostenträger nicht realisierbar ist.
- Für die verbleibenden 73% der Produkte sind über 100 Biosimilars in Entwicklung, was nach Ablauf des Patentschutzes zu einem intensiven Wettbewerb auf dem Markt führen könnte.
2.) Die Kategorie „low sales“ mit einem Jahresumsatz von unter 500 Mio. Euro – 84 Biologika bzw. 76%, fallen in diese Kategorie und stellen damit die überwiegende Mehrheit der biologischen Arzneimittel dar, die das Patent bis Ende 2032 verlieren werden.
- Es wird erwartet, dass nur 7 % dieser Produkte innerhalb der nächsten 10 Jahre Konkurrenz durch Biosimilars erhalten werden.
- Basierend auf dem prognostizierten jährlichen Umsatzvolumen der Produkte, für die keine Biosimilar-Kandidaten in der Entwicklungs-Pipeline sind, wird das nicht realisierbare Einsparpotenzial in Europa auf etwa 7 Milliarden Euro geschätzt.
Somit legen die aktuell verfügbaren Daten nahe, dass der sogenannte „Biosimilar Void“ zu entgangenen Einsparungen von mindestens 15 Mrd. Euro führen könnte. Dies entspricht etwa 25 % des gesamten Einsparpotentials, das sich aus den LoE-Ereignissen bis zum Jahr 2032 entspricht.
VERTEILUNG DER ENTWICKLUNGSTÄTIGKEIT AUF VERSCHIEDENE THERAPIEGEBIETE:
Obwohl die künftigen Patentabläufe fast 30 Therapiegebiete betreffen, konzentrieren sich die Entwicklungsaktivitäten hauptsächlich auf drei Fächer: Onkologie, Immunologie und Ophthalmologie.
- Diese drei Bereiche repräsentieren 41 % aller Originalpräparate mit einem LoE bis 2032 in Europa
- Sie haben jedoch 91 % der gesamten Biosimilar-Entwicklungspipeline angezogen
- Alle anderen Therapiegebiete machen zusammengenommen kurzfristig weniger als 10 % der weltweiten Biosimilar-Pipeline aus
- Bislang wurde nur für ein biologisches Arzneimittel zur Behandlung seltener Erkrankungen (Eculizumab) ein Biosimilar entwickelt.
- Die starke Konzentration der Entwicklungsaktivitäten für Biosimilars scheint darauf hinzudeuten, dass in wichtigen therapeutischen Bereichen der Wettbewerb durch Biosimilars gesichert ist. Langfristig wird jedoch ab 2027 die durchschnittliche Anzahl der Biosimilars in Entwicklung von 2,19 pro Molekül auf 0,43 sinken.
- Hauptgrund für den Rückgang ist der Bereich Onkologie, wo die durchschnittliche Anzahl von Biosimilars in Entwicklung pro Molekül von 4,3 im kurzfristigen Zeitraum (2023-2027) auf 1,2 im langfristigen Zeitraum (2028-2032) zurückgehen wird.
Der starke Rückgang an Biosimilars in Entwicklung könnte mit dem Bewertungszeitraum der vorliegenden Studie zusammenhängen. Dennoch sollte betont werden, dass die Kosten und der zeitliche Aufwand für die Markteinführung eines Biosimilar-Medikaments die Möglichkeiten der Anbieter, neue Produkte zu entwickeln und auf den Markt zu bringen, zunehmend einschränken. Diese Beschränkungen betreffen dabei nicht nur „low sales“ Produkte. Einer der Hauptfaktoren, die die Entwicklungskosten für onkologische Biosimilars in die Höhe treiben, sind die vergleichenden Wirksamkeitsstudien. Die hohen Anschaffungskosten für die entsprechenden biologischen Referenzprodukte und die Notwendigkeit großer Patientenpopulationen, um die festgelegten klinischen Endpunkte gemäß den aktuellen europäischen und globalen Vorschriften zu erfüllen, beschränken die Möglichkeiten der Hersteller, neue Biosimilar-Arzneimittel zu entwickeln.
ZUSAMMENFASSUNG UND BLICK IN DIE ZUKUNFT:
Der aktuelle Bericht legt dar, dass eine Vielzahl komplexer Herausforderungen die umfassende Verfügbarkeit von Biosimilars in Europa in den nächsten Jahren beeinträchtigen wird. Dies deutet darauf hin, dass ein gesicherter Wettbewerb auf dem Markt für Biosimilars nicht zwangsläufig gewährleistet ist. Mögliche Ansatzpunkte zur Adressierung der Herausforderungen sind:
DROHENDE BIOSIMLAR-LÜCKEN VERMEIDEN:
Durch den Blick in die Zukunft und Einführung von Anreizen könnte die Biosimilars Entwicklung stimuliert werden.
STREAMLINING DER STUDIENANFORDERUNGEN:
Die große Mehrheit der Biologika in Europa, deren Patente auslaufen, haben einen prognostizierten Umsatz von weniger als 500 Mio. Euro pro Jahr. Hohe Entwicklungskosten bedeuten, dass die Entwickler von Biosimilars für diese Segmente mit erheblichen Unsicherheiten konfrontiert sind. Die jüngsten wissenschaftlichen Fortschritte und die zunehmende Erfahrung der Aufsichtsbehörden mit Biosimilars bieten die Möglichkeit, den Prüfprozess zu vereinfachen, die Kosten zu senken und die Entwicklungszeiten zu verkürzen. Eine solche Beschleunigung könnte die Biosimilar-Landschaft wesentlich verändern und die Lücke in Europa erheblich verkleinern, insbesondere wenn sie global koordiniert wird.
DIE OPTIMIERUNG VON MARKTBEDINGUNGEN UND BESCHAFFUNGSPROZESSEN BIRGT POTENTIAL FÜR BESSERE VERFÜGBARKEIT, ERSCHWINGLICHKEIT UND VIELFALT DES ANGEBOTS AN BIOSIMILARS
Neben den regulatorischen Regelungen könnte auch die Optimierung der Marktbedingungen die Entwicklungssituation für Biosimilars verbessern. Mit dem Ziel, die Verwendung von Biosimilars zu steigern, könnten für Ärzte entsprechende Anreize geschaffen werden, etwa im Rahmen von Benefit-Share Modellen oder durch Einführung von Verordnungszielen bzw. Marktanteilsquoten. Auch Beschaffungsverfahren, die sich negativ auf die Nachhaltigkeit des Marktes auswirken, sollten überdacht werden. Ausschreibungsverfahren mit singulärem Gewinner und dem Preis als einzigem Kriterium sind in Europa nach wie vor am weitesten verbreitet, obwohl sich Anzeichen häufen, dass dies zu Marktverarmung beiträgt. Modelle, die neben dem Preis auch andere Entscheidungskriterien einbeziehen, können Investitionen in neue Produkteigenschaften, eine umweltfreundliche Produktion und eine nachhaltige Versorgung belohnen, um die Beschaffungspraxis zu verbessern. Änderungen der Beschaffungsprozesse könnten unmittelbar den Preisdruck auf die Hersteller von Biosimilars verringern und damit die Biosimilar-Verfügbarkeit erhöhen.
Wenn man die zunehmenden Hindernisse und Hürden für die Biosimilar-Produktion nicht beachtet, droht eine Biosimilar-Lücke, die Einsparungspotentiale für europäische Gesundheitssysteme und Zugangspotentiale für Patientinnen und Patienten gefährdet. Die Schaffung eines nachhaltigeren Marktes für Biosimilars erfordert eine Neubewertung der derzeitigen europäischen und globalen Rahmenbedingungen für die Regulierung und den Marktzugang, um eine gleichmäßigere Verbreitung von Biosimilar-Arzneimitteln in den relevanten Bereichen zu erleichtern.
iqvia-institute-assessing-the-biosimilar-void-10-23-forweb
Nachsatz des Biosimilarsverbands:
Nachweislich kommen in den nächsten Jahren nicht für alle patentfrei werdenden biologischen Arzneimittel Biosimilars auf den Markt; es droht eine Biosimilars Lücke, die sowohl Gesundheitssysteme durch fehlende Einsparungen als auch Patienten durch eingeschränkte Verfügbarkeit treffen wird. Der Biosimilarsverband appelliert an Politik und Stakeholder im Gesundheitsbereich Maßnahmen zu ergreifen, um sowohl die bereits am Markt verfügbaren als auch neue Biosimilars zu fördern und zu unterstützen. Dies ist entscheidend, um mögliche Einsparungen für das österreichische Gesundheitswesen zu realisieren und Patienten weiterhin optimal, mit modernen und kostengünstigen Behandlungsmethoden zu versorgen.